Un equipo do CiQUS (Universidade de Santiago – USC) e a University of Rice (Houston, EEUU) presenta novos compostos para a detección dos agregados de proteínas relacionados cos primeiros síntomas das enfermidades neurodexenerativas. Os resultados do traballo publicáronse na revista JACS (Journal of the American Chemical Society), referente mundial no ámbito da Química.
 |
|
O Prof. Javier Montenegro (dereita) comenta os resultados co seu colega Ghibom Bhak, primeiro autor do traballo no CiQUS. / (Foto: Andrés Ruiz). |
Os amiloides son unha familia de proteínas encargadas de distintas funcións biolóxicas, cuxo estudo resulta de especial dificultade. Aínda que polo xeral atópanse en estado soluble, sábese que en certas condicións teñen tendencia a agruparse, dando lugar a estruturas fibrosas. Estas estruturas fibrilares, xurdidas da unión de longas cadeas de amiloides, son clave no desenvolvemento de distintos trastornos e, de feito, téñense relacionado xa coa fase inicial de diferentes enfermidades neurodexenerativas –como o alzhéimer ou o párkinson-.
Un dos membros máis coñecidos desta familia é o beta-amiloide. Os científicos estudaron amplamente as súas características nos últimos anos, xa que a acumulación desta proteína en certas rexións do cerebro é un dos selos distintivos da enfermidade de Alzheimer. Non en van, existe unha teoría coñecida como a hipótese da fervenza amiloide, que propón que a mera transición das proteínas beta-amiloide desde o seu estado soluble ata a nova estrutura en forma de fibras sinala o principio do alzhéimer.
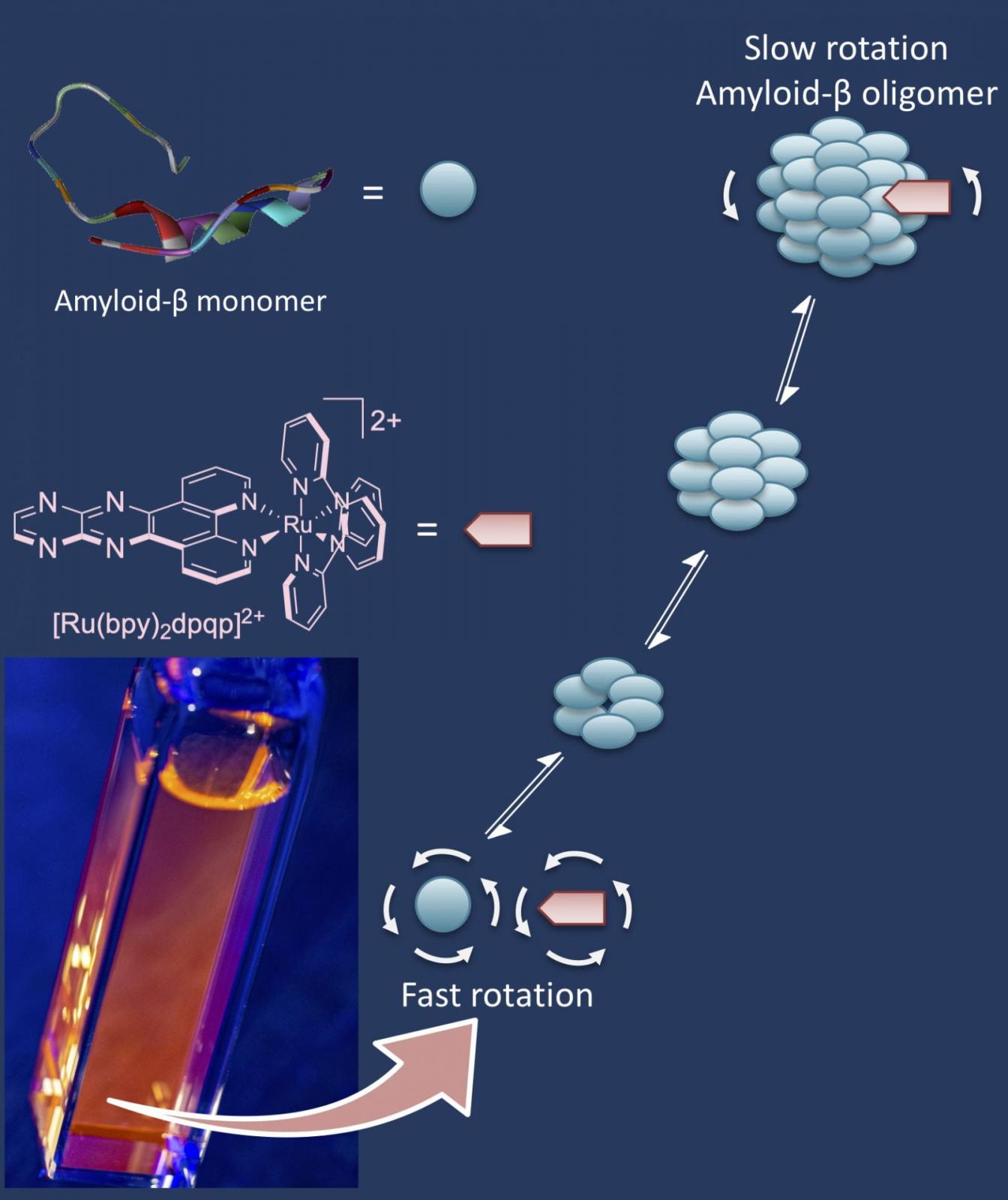
Entender o mecanismo de agregación destas proteínas (ou o que é o mesmo, pescudar como, cando e por que estas proteínas “deciden” agregarse) é un dos principais obxectivos da investigación na área. Con todo, o estudo deste fenómeno segue sendo polo de agora extremadamente complexo, debido principalmente ao carácter dinámico do proceso: os primeiros agregados (é dicir, os primeiras oligómeros ou ‘cadeas de amiloides’ que xorden nos estadios iniciais das patoloxías neurodexenerativas), son de moi pequeno tamaño e, por tanto, difíciles de detectar.
Non están soas
A beta-amiloide non é a única proteína relacionada coas enfermidades neurodexenerativas: existe no cerebro outra proteína soluble chamada alfa-sinucleína, cuxa agregación tamén se ten relacionado co comezo da enfermidade de Párkinson. Do mesmo xeito que ocorre no caso dos amiloides, os primeiros oligómeros que se forman como consecuencia da unión da alfa-sinucleína son agregados pouco estables e moi cambiantes, o que os fai moi difíciles de detectar.
Na actualidade, os principais esforzos de investigación céntranse na detección dos primeiros agrupamentos de ámbalas dúas familias de proteínas; un obxectivo prioritario e en absoluto menor, xa que podería conducir ao diagnóstico temperán destas enfermidades tan devastadoras.
Sinais de alerta en fases temperás
Ata hoxe, a aproximación química para detectar o agrupamento de proteínas amiloides no cerebro centrarase no uso de sensores baseados en moléculas orgánicas fluorescentes (como a tioflavina), que aumentan o seu brillo ao inserirse na proteína acumulada. Con todo, estes sensores fluorescentes só son quen de brillar coa intensidade idónea cando a proteína se atopa xa nun estado de agregación moi avanzado, mentres que os precursores da patoloxía (as fibras e os agrupamentos máis pequenos) pasan inadvertidos.
«Propoñemos unha nova aproximación conceptual para a detección do problema», afirma o Profesor Montenegro |
Agora, un equipo de investigadores do CiQUS (Centro Singular de Investigación en Química Biolóxica e Materiais Moleculares da Universidade de Santiago de Compostela) integrado polo Dr. Ghibom Bhak e o Dr. Javier Montenegro, en colaboración coa Universidade de Rice (Houston, Texas, EEUU) vén de crear novos sensores metálicos fluorescentes para a detección temperá das primeiras agregacións de proteínas vinculadas ás enfermidades de Alzheimer (beta-amiloide) e Parkinson (alfa-sinucleína).
Os novos compostos de renio e rutenio adhírense aos precursores da enfermidade (os oligómeros amiloides) e, dende aí, amplifican a nivel supramolecular un sinal determinante coñecido como anisotropía de fluorescencia; este fenómeno físico, que se produce cando a luz emitida varía en intensidade dependendo de cal sexa o seu eixo de polarización, permite detectar pequenos agregados de amiloides moito antes de que se acumulen, evitando así un diagnóstico tardío en fases avanzadas da enfermidade. O artigo é froito dunha colaboración internacional dirixida polo Profesor Ángel Martí na Universidade de Rice en Houston, e acaba de ser publicado na prestixiosa revista Journal of the American Chemical Society (JACS).
Para Javier Montenegro, líder do grupo do CiQUS que validou os novos compostos sobre a proteína relacionada co Párkinson (a α-sinucleína), o valor deste traballo é dobre: «non só presenta novos compostos organometálicos para a detección temperá dos agregados de amiloides, senón que propón tamén unha nova aproximación conceptual para a detección do problema», afirma.
A nova estratexia sérvese dunha propiedade dos agregados que non fora explorada ata hoxe, alentando así o potencial desenvolvemento de novos sensores e métodos entre a comunidade científica. Como apunta Javier Montenegro, «abordar este problema mediante a anisotropía de fluorescencia supón apostar por unha nova aproximación para o diagnóstico temperán, porque nos permite detectar moito antes a formación dunha anomalía que podería estar relacionada con condicións patolóxicas moi importantes».
Referencias
Monitoring the Formation of Amyloid Oligomers Using Photoluminescence Anisotropy
Bo Jiang, Amir Aliyan, Nathan P. Cook, Andrea Augustine, Ghibom Bhak, Rodrigo Maldonado, Ashleigh D. Smith McWilliams, Erick M. Flores, Nicolas Mendez, Mohammad Shahnawaz, Fernando J. Godoy, Javier Montenegro, Ines Moreno-Gonzalez, and Angel A. Martí. Journal of the American Chemical Society DOI: 10.1021/jacs.9b06966