A tesis céntrase no desenvolvemento de novos antibióticos para o tratamento das infeccións bacterianas, cuxo modo de acción se basea na inhibición selectiva e eficaz dun dos enzimas implicados na biosíntese dos aminoácidos aromáticos, a siquimato quinasa.
 A estudante de doutoramento do CiQUS Verónica Prado López defendeu esta mañá na Facultade de Química a súa tese titulada “Inhibidores da Siquimato Quinasa para o Tratamento de Infeccións Bacterianas: Deseño, Síntese e Avaliación Biolóxica”, supervisada por Concepción González Bello, profesora titular e investigadora principal do centro.
A estudante de doutoramento do CiQUS Verónica Prado López defendeu esta mañá na Facultade de Química a súa tese titulada “Inhibidores da Siquimato Quinasa para o Tratamento de Infeccións Bacterianas: Deseño, Síntese e Avaliación Biolóxica”, supervisada por Concepción González Bello, profesora titular e investigadora principal do centro.
A tese céntrase no desenvolvemento de novos antibióticos para o tratamiento das infeccións bacterianas, cuxo modo de acción se basea na inhibición selectiva e eficaz dun dos enzimas implicados na biosíntese dos aminoácidos aromáticos, a siquimato quinasa. Este enzima é esencial nas bacterias patóxenas relevantes tales como Mycobacterium tuberculosis, o bacilo causante da tuberculose, e Helicobacter pylori, responsable da gastrite crónica e está asociada coa úlcera gastroduodenal. Nalgúns casos, as persoas infectadas con este patóxeno corren ademais o risco de padecer cancro de estómago.
Para o deseño dos inhibidores realizouse en primeiro lugar un estudo detallado do mecanismo de transferencia de fosforilo catalizado polo enzima. Desenvolveuse para iso un método sinxelo e rápido de espectroscopía de Resonancia Magnética Nuclear de 1H e 31P que permitiu establecer, en contra do asociativo previamente proposto, que o mecanismo é disociativo. En base ao mecanismo de acción e a un estudo computacional detallado dos requisitos estructurais da unión dos sustratos ao centro activo, así como dos movementos esenciais para que teña lugar a rexeneración catalítica, realizouse o deseño dos inhibidores. Tendo en conta que os enzimas son sistemas “dinámicos e flexibles” capaces de adoptar 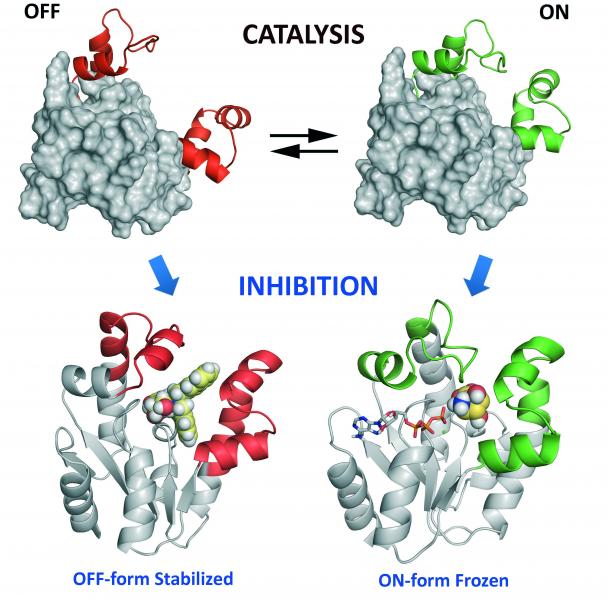 diversas conformacións durante a catálise – desde a aberta (inactiva, OFF) á pechada (activa, ON) - abordouse a inhibición da siquimato quinasa mediante a desactivación da flexibilidade do enzima, que é imprescindible para a rexeneración catalítica. Sintetizáronse compostos capaces de estabilizar a forma pechada do centro activo así como outros que impiden o peche do mesmo.
diversas conformacións durante a catálise – desde a aberta (inactiva, OFF) á pechada (activa, ON) - abordouse a inhibición da siquimato quinasa mediante a desactivación da flexibilidade do enzima, que é imprescindible para a rexeneración catalítica. Sintetizáronse compostos capaces de estabilizar a forma pechada do centro activo así como outros que impiden o peche do mesmo.
Estas investigacións permitiron a identificación de varios candidatos moi potentes fronte ao enzima cunha excelente actividade in vitro fronte ás bacterias M. tuberculosis ey H. pylori. Mediante estos estudos demostrouse ademais que esta estratexia baseada no movemento, pode ser un método atractivo para lograr a inhibición “selectiva” de enzimas homólogos con ligandos que inciden na mesma zona. Parte dos resultados obtidos nesta tese de doutoramento xa se publicaron en catro traballos en revistas de grande prestixio internacional: J. Am. Chem. Soc. 2013, 135, 12366, Chem. Eur. J. 2016, 22, 2758, J. Med. Chem. 2016, 59, 5471 e Chem. Eur. J. 2016, 22, en prensa e que foron destacados na portada da revista J. Med. Chem. e recentemente como artígo Frontispecie en Chem. Eur. J.


