La tesis se centra en el desarrollo de nuevos antibióticos para el tratamiento de las infecciones bacterianas, cuyo modo de acción se base en la inhibición selectiva y eficaz de uno de los enzimas implicados en la biosíntesis de los aminoácidos aromáticos, la siquimato quinasa
 La estudiante de doctorado del CiQUS Verónica Prado López ha defendido esta mañana en la Facultad de Química su tesis doctoral titulada “Inhibidores de la Siquimato Quinasa para el Tratamiento de Infecciones Bacterianas: Diseño, Síntesis y Evaluación Biológica”, supervisada por Concepción González Bello, profesora titular e investigadora principal del CiQUS.
La estudiante de doctorado del CiQUS Verónica Prado López ha defendido esta mañana en la Facultad de Química su tesis doctoral titulada “Inhibidores de la Siquimato Quinasa para el Tratamiento de Infecciones Bacterianas: Diseño, Síntesis y Evaluación Biológica”, supervisada por Concepción González Bello, profesora titular e investigadora principal del CiQUS.
La tesis se centra en el desarrollo de nuevos antibióticos para el tratamiento de las infecciones bacterianas, cuyo modo de acción se base en la inhibición selectiva y eficaz de uno de los enzimas implicados en la biosíntesis de los aminoácidos aromáticos, la siquimato quinasa. Este enzima es esencial en bacterias patógenas relevantes tales como Mycobacterium tuberculosis, el bacilo causante de la tuberculosis, y Helicobacter pylori, responsable de la gastritis crónica y está asociada con la úlcera gastroduodenal. En algunos casos, las personas infectadas con este patógeno corren además el riesgo de padecer cáncer de estómago.
Para el diseño de los inhibidores se realizó en primer lugar un estudio detallado del mecanismo de transferencia de fosforilo catalizado por el enzima. Se desarrolló para ello un método sencillo y rápido de espectroscopía de Resonancia Magnética Nuclear de 1H y 31P que permitió establecer, en contra del asociativo previamente propuesto, que el mecanismo es disociativo. En base al mecanismo de acción y a un estudio computacional detallado de los requisitos estructurales de la unión de los sustratos al centro activo, así como de los movimientos esenciales para que tenga lugar la regeneración catalítica, se realizó el diseño de los inhibidores. Teniendo en cuenta que los enzimas son sistemas “dinámicos y flexibles” capaces de adoptar 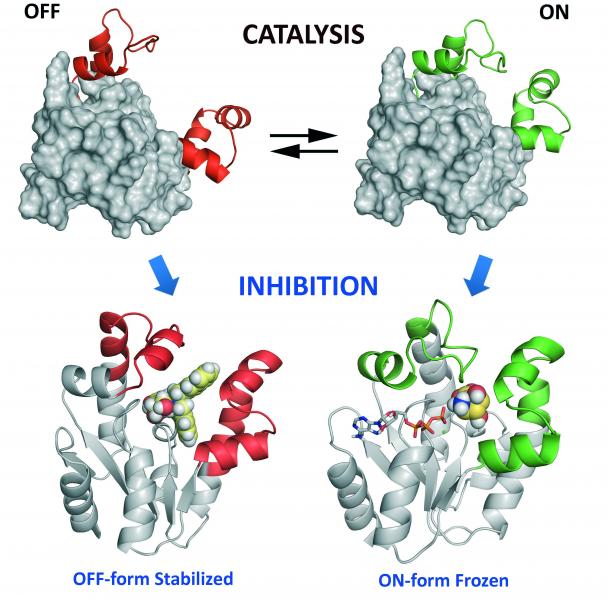 diversas conformaciones durante la catálisis – desde la abierta (inactiva, OFF) a la cerrada (activa, ON) - se abordó la inhibición de la siquimato quinasa mediante la desactivación de la flexibilidad del enzima, que es imprescindible para la regeneración catalítica. Se sintetizaron compuestos capaces de estabilizar la forma cerrada del centro activo así como otros que impiden el cierre del mismo.
diversas conformaciones durante la catálisis – desde la abierta (inactiva, OFF) a la cerrada (activa, ON) - se abordó la inhibición de la siquimato quinasa mediante la desactivación de la flexibilidad del enzima, que es imprescindible para la regeneración catalítica. Se sintetizaron compuestos capaces de estabilizar la forma cerrada del centro activo así como otros que impiden el cierre del mismo.
Estas investigaciones permitieron la identificación de varios candidatos muy potentes frente al enzima con una excelente actividad in vitro frente a las bacterias M. tuberculosis y H. pylori. Mediante estos estudios se demostró además que esta estrategia basada en el movimiento, puede ser un método atractivo para lograr la inhibición “selectiva” de enzimas homólogos con ligandos que inciden en la misma zona. Parte de los resultados obtenidos en esta tesis doctoral ya se publicaron en cuatro trabajos en revistas de gran prestigio internacional: J. Am. Chem. Soc. 2013, 135, 12366, Chem. Eur. J. 2016, 22, 2758, J. Med. Chem. 2016, 59, 5471 y Chem. Eur. J. 2016, 22, en prensa y que fueron destacados en la portada de la revista J. Med. Chem. y recientemente como artículo Frontispecie en Chem. Eur. J.


