Ana Ríos Rodríguez y Juan Crugeiras
La determinación de constantes de velocidad para la desprotonación de ácidos de carbono en D2O se puede llevar a cabo utilizando la espectroscopía RMN 1H con el fin de monitorizar la incorporación de deuterio en el carbono. Los datos de velocidad se pueden combinar con relaciones velocidad-equilibrio conocidas para la transferencia protónica en el carbono con el fin de obtener un valor para el p(Ka)CH de estos ácidos. Hemos aplicado esta metodología al estudio de la estabilidad cinética y termodinámica de enolatos de aminoácidos y sus derivados en disolución acuosa (JACS 1997, 119, 8375; JACS 2000, 122, 9373; JACS 2002, 124, 8251). Estos estudios nos han permitido obtener los primeros valores fiables de la acidez de los protones en la posición α de aminoácidos en agua. Estos valores de p(Ka)CH son esenciales para caracterizar la reactividad química de estos compuestos biológicos.
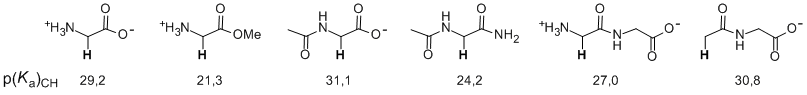
Los resultados de esta investigación son de gran importancia para analizar el mecanismo de catálisis de las racemasas de aminoácidos que no requieren un cofactor para desarrollar su actividad catalítica. Así, este estudio sugiere que el catalizador enzimático desempeña dos funciones importantes con el fin de optimizar la fuerte estabilización electrostática de los enolatos de aminoácidos debida a interacciones entre el grupo amonio positivo y la carga negativa del oxígeno. (a) Las racemasas de aminoácidos se unen a la forma más abundante de los aminoácidos a pH fisiológico, el zwitterión, y activan esta especie para la enolización mediante la protonación del grupo carboxilato en un equilibrio previo o por catálisis ácida general en el grupo carbonilo. (b) El centro activo de la enzima proporciona un medio de baja constante dieléctrica que maximiza la estabilización del enolato zwitteriónico por interacciones electrostáticas intramoleculares.



